Conţinut
- Diferența principală
- lantanidelor vs. actinide
- Diagramă de comparație
- Ce sunt Lanthanides?
- Ce sunt Actinide?
- Diferențele cheie
- Concluzie
Diferența principală
Principala diferență între lantanide și actinide este că lantanidele sunt acele elemente chimice ale f blocului din tabelul periodic care nu formează complexele ușor, în timp ce actinidele sunt acele elemente chimice ale blocului f din tabelul periodic care pot forma complexele cu ușurință.
lantanidelor vs. actinide
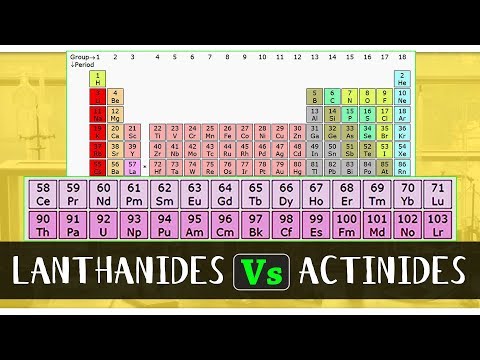
elementele de bloc f sunt elemente în care ultimul electron intră în f orbitalul atomilor lor. Aceste elemente sunt, de asemenea, caracterizate ca elemente de tranziție interioară. Ele constau din două serii care includ lantanidele și actinidele. Seria lantanidelor este seria de elemente chimice care cuprinde 15 elemente chimice metalice care conțin numere atomice 57 până la 71, de la lantan până la lutetiu. Seria de actinide, pe de altă parte, este seria de elemente chimice care cuprinde 15 elemente chimice metalice care conțin numere atomice de la 89 la 103, actinium prin lawrencium.
Lantanidele sunt considerate elementele non-radioactive, cu excepția Promethium. Toate actinidele, de partea flip, sunt considerate elemente radioactive datorită naturii instabile pe care o au.
Diagramă de comparație
| lantanidelor | actinide |
| Elementele chimice sunt prezente în seria lantanidă a blocului f din tabelul periodic se numesc lantanide. | Elementele chimice care sunt prezente în seria de actinide ale blocului f din tabelul periodic se numesc actinide. |
| Numar atomic | |
| Numărul atomic al elementelor prezente în seria lantanidelor este cuprins între 57 și 71. | Numărul atomic al elementelor prezente în seria actinidelor este cuprins între 89 și 103. |
| Poziția în tabelul periodic | |
| În tabelul periodic, lantanidele sunt situate în seria lantanidelor din blocul f. | În tabelul periodic, actinidele sunt localizate în seria de actinide ale blocului f. |
| Statele de oxidare | |
| Stările de oxidare prezentate de lantanide sunt +2, +3 și +4. | Stările de oxidare prezentate de actinide sunt +3, +4, +5 și +6. |
| Stare maximă de oxidare | |
| Starea de oxidare maximă indicată de lantanide este de +4. | Starea maximă de oxidare prezentată de actinide este +6. |
| Radioactivitate | |
| Lantanidele sunt considerate elementele non-radioactive, cu excepția Promethium. | Toate actinidele sunt considerate elemente radioactive datorită naturii lor instabile. |
| Oxocations | |
| Lantanidele nu sunt implicate în formarea oxocațiilor precum oxizii și hidroxizii. | Actinidele sunt responsabile de formarea oxocațiilor precum oxizii și hidroxizii. |
| Comportament de bază | |
| Lantanidele prezintă un comportament mai puțin de bază. | Actinidele prezintă un comportament mai de bază. |
| Activitatea chimică | |
| Lantanidele prezintă o tendință mai mică spre formarea complexelor. | Actinidele prezintă o tendință mai puternică spre formarea complexelor. |
| Efect de colorat | |
| Aproape toți ionii care sunt formați de lantanide sunt incolori. | Majoritatea complexelor formate din actinide sunt colorate. |
| Toxicitate | |
| Lantanidele nu sunt compuși toxici. | Actinidele sunt considerate compuși toxici datorită comportamentului metalelor grele și radioactivității. |
| Electroni de valență | |
| Electronii de valență ai lantanidelor sunt localizați în orbitalul 4f. | Electronii de valență ai actinidelor sunt localizați în orbitalul 5f. |
Ce sunt Lanthanides?
Lantanidele sunt acele elemente chimice ale blocului f din tabelul periodic care nu formează complexele cu ușurință. Numărul atomic de lantanide variază între 57 și 71. Întrucât sunt elemente metalice, astfel încât acestea se oxidează în aerul umed. De asemenea, sunt capabili să se dizolve rapid în acizi. Lantanidele pot reacționa cu oxigenul și halogenurile, dar această reacție are loc lent. Nu sunt capabili să prezinte o stare de oxidare +6. Acesta este motivul pentru care nu pot forma molecule complexe. Lantanidele sunt considerate elemente electropozitive. Prin urmare, aceștia oferă prioritate fabricarea moleculelor cu elementele electronegative. Dar modificările proprietăților fizice și chimice sunt foarte puține pe parcursul seriei.
Ce sunt Actinide?
Actinidele sunt acele elemente chimice ale blocului f din tabelul periodic care pot forma ușor complexele. Numărul atomic de actinide variază între 89 și 103. Cele mai multe și mai frecvente actinide găsite pe pământ sunt Toriul și Uraniul. Ele eliberează energie ridicată în timpul degradării radioactive. Starea proeminentă de oxidare care este arătată de actinide este +3. Actinidele formează hidroxizii și oxizii de bază. Sunt capabili să formeze complexe cu liganzi, cum ar fi sulfați, cloruri, etc. Majoritatea complexelor formate de actinide sunt colorate. Dar actinidele sunt considerate compuși toxici datorită comportamentului lor de metale grele și radioactivitate.
Diferențele cheie
- Elementele chimice sunt prezente în seria lantanidă a blocului f din tabelul periodic se numesc lantanide, în timp ce elementele chimice care sunt prezente în seria de actinide ale blocului f din tabelul periodic se numesc actinide.
- Numărul atomic al elementelor prezente în seria lantanidelor este cuprins între 57 și 71; pe de altă parte, numărul atomic al elementelor prezente în seria de actinide variază între 89 și 103.
- În tabelul periodic, lantanidele sunt situate în seria lantanidelor din blocul f. În schimb, în tabelul periodic, actinidele sunt localizate în seria de actinide ale blocului f.
- Stările de oxidare prezentate de lantanide sunt +2, +3 și +4, pe partea flip, stările de oxidare prezentate de actinide sunt +3, +4, +5 și +6.
- Starea de oxidare maximă indicată de lantanide este de +4; pe de altă parte, starea de oxidare maximă prezentată de actinide este +6.
- Lantanidele sunt considerate elementele non-radioactive, cu excepția Promethium, în timp ce toate actinidele sunt considerate elemente radioactive din cauza naturii lor instabile.
- Lantanidele nu sunt implicate în formarea oxocațiilor precum oxizii și hidroxizii; pe de altă parte, actinidele sunt implicate în formarea oxocațiilor precum oxizii și hidroxizii.
- Lantanidele prezintă un comportament mai puțin bazic, în timp ce actinidele prezintă un comportament mai de bază.
- Lantanidele prezintă o tendință mai mică spre formarea complexelor, pe partea înclinată, actinidele prezintă o tendință mai puternică spre formarea complexelor.
- Aproape toți ionii care sunt formați de lantanide sunt incolori; pe de altă parte, majoritatea complexelor actinidelor sunt colorate.
- Lantanidele nu sunt compuși toxici. În schimb, actinidele sunt considerate compuși toxici datorită comportamentului metalelor grele și a radioactivității.
- Electronii de valență ai lantanidelor se găsesc în orbitalul 4f, pe de altă parte, electronii de valență ai actinidelor se găsesc în orbitalul 5f.
Concluzie
Discuția de mai sus rezumă că lantanidele sunt considerate elemente non-radioactive și au unele excepții, în timp ce actinidele sunt elementele radioactive. Primele nu puteau forma complexele cu ușurință, în timp ce al doilea ar putea forma complexe ușor.


